-
Case Processing & Reporting
Individual Case Safety Reports (ICSR) in Pharmacovigilance

개별 약물이상반응 및 이상사례를 수집하고 관리하는 것은 약물감시(PV)의 기본입니다.
PV team은 검증된 정보 수집, 사례평가와 품질관리를 수행하며 국내 및 글로벌 규정에 따른 식약처 보고와 같은 서비스를 제공합니다.Service Scope
PV team은 아래와 같은 서비스를 제공합니다.
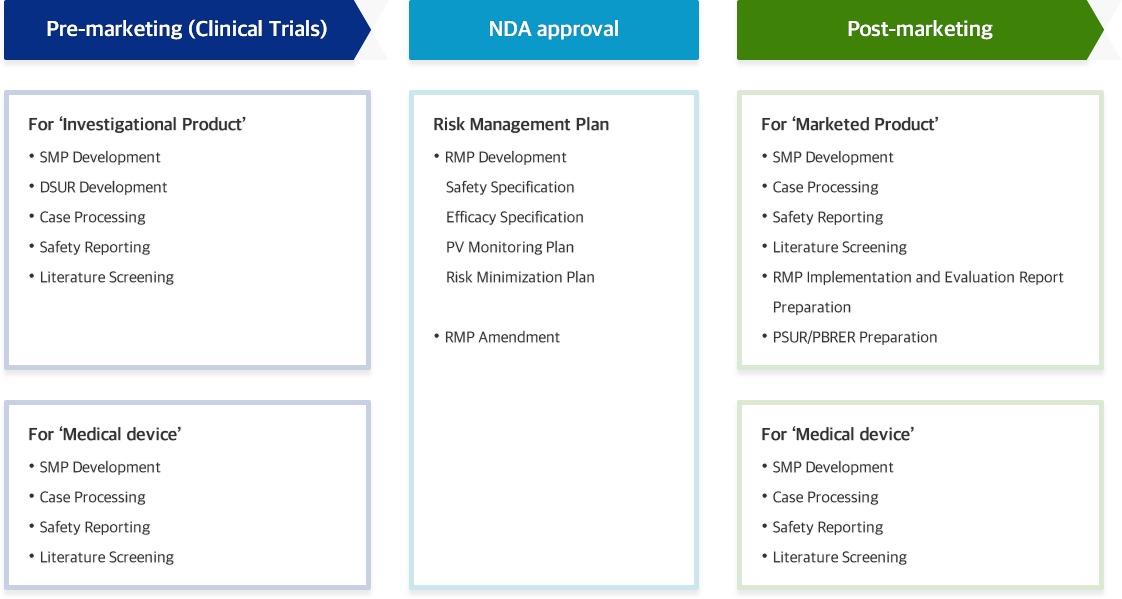
Pre-marketing (Clinical Trials) Complete management and assessment of SAE/SUSAR Post-Marketing Complete management and assessment of ICSR Safety Reporting Safety Reporting to CA Service Contents
- Receipt and triage of ICSRs
- Data entry
- Medical assessment
- MedDRA coding
- Narrative production
- Analysis of Similar Events (AOSE)
- Quality control (QC)
- CIOMS generation and distribution
- Expedited and Periodic reports submission to CA
- Reconciliation with external, internal data
PV team strengths
-
정보수집 및 사례처리의 전문성
PV team은 다양한 배경과 경험 및 PV 교육을 이수한 전문인력이 안전성 정보를 관리하고, 모든 보고서의 완성도와 정확도를 높이기 위해 품질관리를 진행합니다.
당사의 숙련된 약물 감시 직원은 case processing, MedDRA coding 검토 및 각 보고서의 품질 관리 수행에 관여합니다. -
규정에 따른 보고
규정정보(Regulatory intelligence)관리는 약물감시 업무의 핵심 요소입니다. 이에 최신 규정 변경사항을 파악하고 ‘핵심규정 보고요구사항’ 정보를 주기적으로 업데이트 하고 있습니다. 규정에 따른 안전성 정보관리는 당사의 주요 서비스입니다.
-
Timeline 준수
신속보고 및 정기보고의 기한을 준수하는 것을 최우선으로 합니다.
-
Safety Management Plan
Safety Management Plan (SMP) Development

약물감시 활동 계획서(SMP)는 의뢰자와 CRO간의 약물감시 활동 및 안전성 정보 수집에 관한 역할, 책임 및 프로세스에 대해 합의된 문서입니다.
Service Scope
PV team이 제공 가능한 SMP Development 서비스는 다음과 같습니다.
Pre-Marketing (Clinical Trials) Safety Management Plan (SMP) development Post-Marketing Safety Management Plan (SMP) development Medical Device Safety Management Plan (SMP) development PV team strengths
-
SMP 개발의 전문성
PV 팀은 임상시험, 시판 후 및 의료기기와 관련된 SMP 개발 및 문서작성에 다양한 경험을 보유하고 있습니다.
-
높은 수준의 SMP 유지
의뢰사와 협력하여 규정을 준수하고 논의된 사항을 바탕으로 안전성 정보관리를 효율적으로 수행합니다.
-
-
Risk Management Plan
Risk Management Plan (RMP) support for MFDS submissions

위해성관리계획(RMP)은 품목허가 신청 시 또는 시판 후에 안전성 검토를 위해 제출이 필요한 문서입니다.
안전성, 유효성 검토와 확인, 의약품 감시계획 및 위해성 완화 조치방법 등이 포함하여 RMP 개발을 진행합니다.Service Scope
PV team은 다음과 같은 RMP와 관련된 서비스를 제공합니다.
RMP Development 위해성관리계획 개발 - 안전성 중점검토항목
- 유효성 중점검토항목
- 의약품 감시계획
- 위해성 완화 조치방법
RMP Amendment 위해성관리계획 개정 Service Contents
- 위해성 설정 (중요한 규명된 위해성, 중요한 잠재적 위해성, 부족 정보)
- 유효성 항목 검토, 요약 및 작성
- 의약품 감시 계획(Pharmacovigilance Plan) 검토, 요약 및 작성
- 위해성 완화 조치방법 개발 및 작성
PV team strengths
-
전문적인 RMP 개발
PV 팀은 RMP 개발, 위해성 설정, 유효성 항목 검토, 위해성 완화 조치방법 개발 및 작성 대한 경험을 가지고 있습니다.
-
근거에 입각한 위해성 설정
근거에 입각한 상세한 안전성 정보를 바탕으로 위해성 설정에 도움을 드립니다.
-
Aggregate Reporting

품목허가를 받은 자는 수집된 제품의 안전성 정보에 대하여 글로벌 및 국내 규정에 따라 정기적으로 보고가 필요합니다.
PV team은 안전성 정보에 대한 정기보고서를 준비하며 관리합니다.Service Scope
포괄적이고 과학적인 문헌검색을 통해 중요한 실마리 정보를 식별하여 제공합니다.
Pre-marketing (Clinical Trials) 임상시험용의약품 최신 안전성정보 보고
DSUR: Development safety update reportPost-marketing 정기적인 유익성-위해성 평가 보고서(PBRER) 작성
PBRER Periodic Benefit Risk Evaluation Report정기적인 최신 안전성정보 보고
PSUR: Periodic safety update report위해성관리계획 이행·평가 결과 작성
RMP Implementation and Evaluation ReportService Contents
- 안전성 정보 보고의 일정 개발 및 관리
- 안전성 정보 보고서 작성, 의학적 검토, 국내 보고 규정에 따른 Reformatting
- 식약처 질의응답에 대한 대응
PV team strengths
-
다수의 정기적인 보고서 작성 경험
PV팀은 규정 및 지침에 따라 PSUR/PBRER 및 RMP 정기 이행 평가 결과 보고서와 같은 정기적인 보고서에 대한 다양한 경험을 가지고 있습니다.
-
높은 수준의 정기적인 보고서 제공
규정을 준수하고 의뢰사와 논의된 사항을 바탕으로 안전성 정보 관리를 효율적으로 수행합니다.
-
Literature screening

문헌검색은 실마리 정보(signal detection)와 새로운 안전 문제(ESI) 감지에 중요한 출처입니다.
본사는 국제 수준의 과학·의학 문헌검색을 수행합니다.Service Scope
PV team은 아래와 같은 서비스를 제공합니다.
Literature screening Monthly updates for literature. PV team strengths
-
전문적인 문헌검색 진행
포괄적이고 과학적인 문헌검색을 통해 중요한 실마리 정보를 식별하여 제공합니다.
-
-
Medical Devices Vigilance
SMP Development & Adverse Incident Management

Medical Device Vigilance는 의료기기 사용과 관련하여 발생한 이상사례 및 제품문제에 대한 관리를 뜻합니다.
Service Scope
PV team은 안전성 정보의 수집, 의학적 평가 및 보고 서비스를 제공합니다.
Safety Management Plan (SMP) development Safety Management Plan (SMP) development Case processing Complete management and assessment of ICSR Safety reporting to CA Safety Reporting to CA Literature screening Monthly updates for literature Service Contents
- Safety Data Management
- Adverse Device Effect (ADE) and Medical Device Incident (MDI) case processing, coding, and follow-up
- Narrative production
- Quality control (QC)
- MedWatch creation and distribution
- Device Vigilance Report preparation and submission to MFDS and NIDS
- Literature search and review
PV team strengths
-
의료기기감시 전문인력 보유
PV 팀은 의료기기 이상반응 관리에 대한 경험이 있는 전문인력이 있습니다.
-
의료기기감시 시스템 구축
전문적인 의료기기감시 프로세스와 규정을 바탕으로 안전성 정보보고를 수행합니다.
Pharmacovigilance
-
Case Processing
& Safety Reporting
Individual Case Safety Reports (ICSR) in Pharmacovigilance
Expedited, Periodic reports
VIEW
submission to CA -
Safety Management Plan
(SMP)
Safety Management Plan (SMP)
DevelopmentSMP details the roles,
VIEW
responsibilities, processes, and
timelines for all safety activities. -
Risk Management Plan
(RMP)
Risk Management Plan (RMP)
support for CA submissionsRMP Development
VIEW
RMP amendment -
Aggregate Reporting

RMP Implementation and Evaluation Report Preparation
PSUR/PBRER Preparation
VIEW
DSUR Development -
Literature screening

Searching literature on a local and international level
VIEW -
Medical Devices Vigilance

SMP Development
VIEW
&
Adverse Incident Management