Clinical Development
- Medical Writing
- Clinical Operation
- Late Phase Study
- Data Management
- Biostatistics
- Regulatory Affairs
-

서비스 개요(About Service)
다양한 치료 영역의 임상시험 실무 경험을 가진 Medical writer들이 ICH-GCP/KGCP 및 식품의약품안전처, FDA, EMA 규정 및 가이드라인을 준수하여 임상시험 설계 및 계획서를 개발하고, 결과보고서 등을 작성합니다.
국내/외 제약사, 벤처 및 바이오테크놀로지 분야 등 다양한 의뢰사에게 과학적, 체계적, 윤리적인 임상시험 디자인과 문서를 제공하고 있으며, 내부 통계팀, 임상팀, 데이터관리팀과 함께 전략적으로 협력하여 질 높은 서비스를 신속하게 제공하고 있습니다.서비스 범위 (Service scope)
- Preparation of clinical trial documentation
- Study synopsis and protocol development
- Investigator brochures
- Informed consent forms and other patient material
- Preparation/adaptation of clinical documentation
- Clinical study reports
- CTD (Common Technical Document)
- Conference Presentation Support
- Medical and scientific literature reviews
서비스 프로세스 (Service process)
Protocol development
- discuss with client
- research the paper
- design and development
- internal QC
- client review and approval
- develop the protocol
CSR development
- Study
assignment - review
the protocol - statistical analysis protocol
and collected data - writing the CSR
- internal QC
- client review
and approval - CSR finalization
-

서비스 개요(About Service)
임상시험 전 과정에 걸쳐 글로벌 스탠다드에 부합하는 임상시험 관련 서비스를 제공하며, 정확한 일정을 위해 위험, 비용 및 지연 가능성을 줄이고
성공으로 이끄는 데 도움을 드리고 있습니다.
1) 당사는 ICH-GCP 및 KGCP 지침을 준수합니다.
2) 다양한 글로벌 및 현지 연구 경험을 보유하고 있습니다.
3) 높은 수준의 인프라를 보유하고 있습니다.-
Project Management
10년 이상의 경험이 풍부한 우수한 전문인력이 안정적으로 프로젝트에 집중하여, 사전에 위험을 관리하고(Proactive Risk Management),
Issue & Quality Management 을 통해서 품질과 스피드를 동시에 충족 시키도록 도움을 드리고 있습니다. -
Clinical Monitoring and Site Management
인증된 내부 임상시험종사자 교육 실시 및 CRA Training Program 을 통해 CRA Line Manager들이 CRA 교육에 집중하여
보다 전문적인 Clinical Monitoring and Site Management Services를 제공해 드리고 있습니다. -
Study Start-Up
다양한 임상시험 및 실시기관 진행 경험이 풍부한 Study Start-up 전담팀이 구성되어 있으며, 신속하고 체계적인 Set-up 을 완료하여
계획된 일정에 차질 없이 임상시험을 시작할 수 있도록 도움 드리고 있습니다. -
Quality Control
임상사업본부 내 별도의 QC팀을 구성하여 프로젝트별 QC 방문과 임상시험 기본문서 점검을 수행하여 규정, SOP 및 Protocol 에 따라
임상시험이 적절하게 수행되고 있는지 주기적인 품질관리를 시행하고 있습니다.
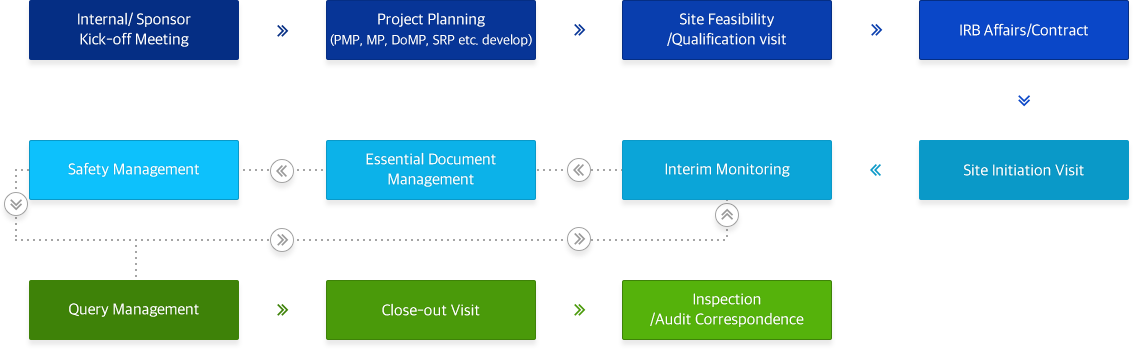
서비스 범위(Service Scope)
- Investigator’s meeting
- Feasibility
- Site Qualification Visit
- IRB Submission
- Site Contract
- PMP, MP, DoMP, SRP etc.
development - Initiation, interim monitoring,
and study close-out visits - Essential document management
(collection, review, archive, etc.) - Clinical Supply management
- Communication with site staffs
- Study specific training to site personnel
- Safety Management
- Pharmacy monitoring
- Query Management
- Inspection Preparation
& Correspondence
서비스 프로세스 (Service process)
-
-

서비스 개요(About Service)
HYUNDAI ADM BIO는 다양한 치료영역에 대한 풍부한 경험, 국내 및 글로벌 프로젝트의 운용 경험 및 Audit 경험을 가진 전문가를 보유하고 있으며, 사내 교육 관리 시스템을 통해 전문지식을 갖추어 프로젝트에 대한 높은 수준의 이해도를 바탕으로 고객의 요구에 맞춘 최적의 서비스를 제공합니다.
강점(Strength)
- Late Phase Study 전담 사업부서와 별도의 SOP가 구성되어 LPS 특화된 서비스와 원활한 업무 지원을 제공합니다.
- 국내 및 글로벌 프로젝트의 운용 및 Audit 경험, 다양한 치료영역에 대한 풍부한 경험을 가진 전문가를 통해 신속하고 고품질의 서비스를 제공합니다.
- 연구에 대한 최신 규정 및 지침에 따라 고객의 구체적이고 다양한 요구를 충족할 수 있도록 최적화된 서비스를 제공합니다.
- 규정 및 가이드라인, 업무 관련 및 질환 교육 등 사내 교육 관리 시스템을 통해 전문지식을 갖추어 프로젝트에 대한 높은 수준의 이해도를 바탕으로 고객의 요구에 맞춘 최적의 서비스를 제공합니다.
서비스 범위(Service Scope)
-
Late Phase Study Operation
- Project Management
- Feasibility Activities
- IRB Affairs
- Site Contract and Payment
- Site Visits
- Safety Management
- Site Management
- Document Management
-
Medical Writing for LPS
- Protocol Development
- ICF Development
- CSR Writing
- Periodic/Re-examination Report Writing
-

서비스 개요(About Service)
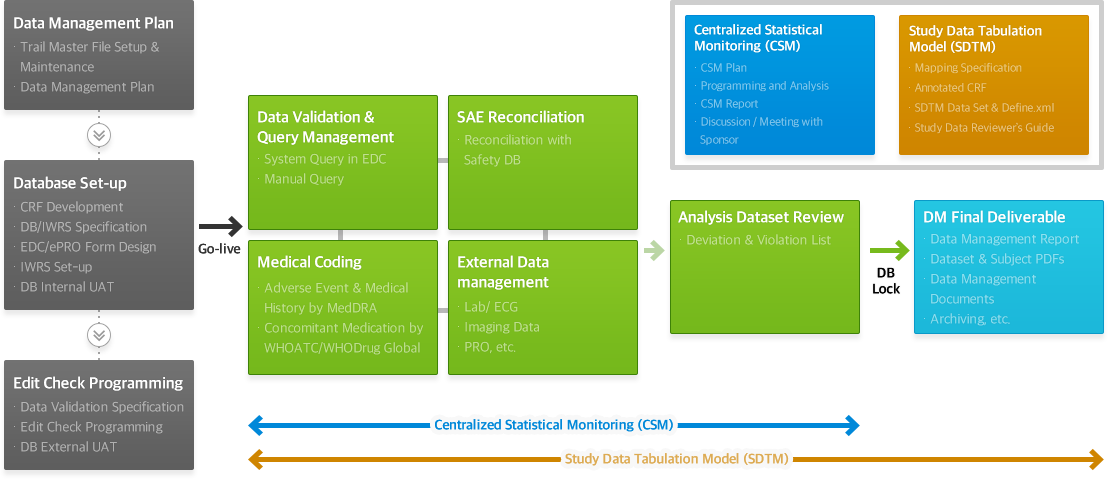
HYUNDAI ADM BIO DM팀의 임상데이터전문가들은 임상시험, 시판 후 조사, 의료기기 등 각각의 다양한 임상연구에서 풍부한 실무경험과 효율적인 프로세스를 바탕으로 CRF 개발, 임상시험 시스템 Set-up, 데이터 관리, Centralized Statistical Monitoring, CDISC 표준에 따른 결과 생성까지 전문적이고 신뢰성 있는 서비스를 제공하고 있습니다. 특히, 임상시험 솔루션들의 R&D 경험이 있는 인원들이 EDC Build 및 C#, SAS Programming 등을 사용한 Data Validation Programming을 진행하여 Qualified service를 제공하고 있습니다.
(Clinical Data Management System:
- CRScube: cubeCDMS, cubePRO
- Medidata: Rave EDC, RTSM, eCOA)서비스 범위(Service Scope)
- CRF/CRF Completion
Guideline Development - Data Management Plan
- Customized Database
Design and Validation - Data Validation and
Query Management - Data Review Listings for
study whole data - Medical Coding (MedDRA, WHOATC,
WHODrug Global etc.) - SAE Reconciliation
- External Data Management
- Protocol Deviation List Generation
- Database Quality Control
- Database Lock
- Data Management Report
- Electronic Data Transfer
- CDISC SDTM
(Study Data Tabulation Model) - CSM (Centralized Statistical Monitoring)
based RBM
서비스 프로세스 (Service process)
- CRF/CRF Completion
-

서비스 개요(About Service)
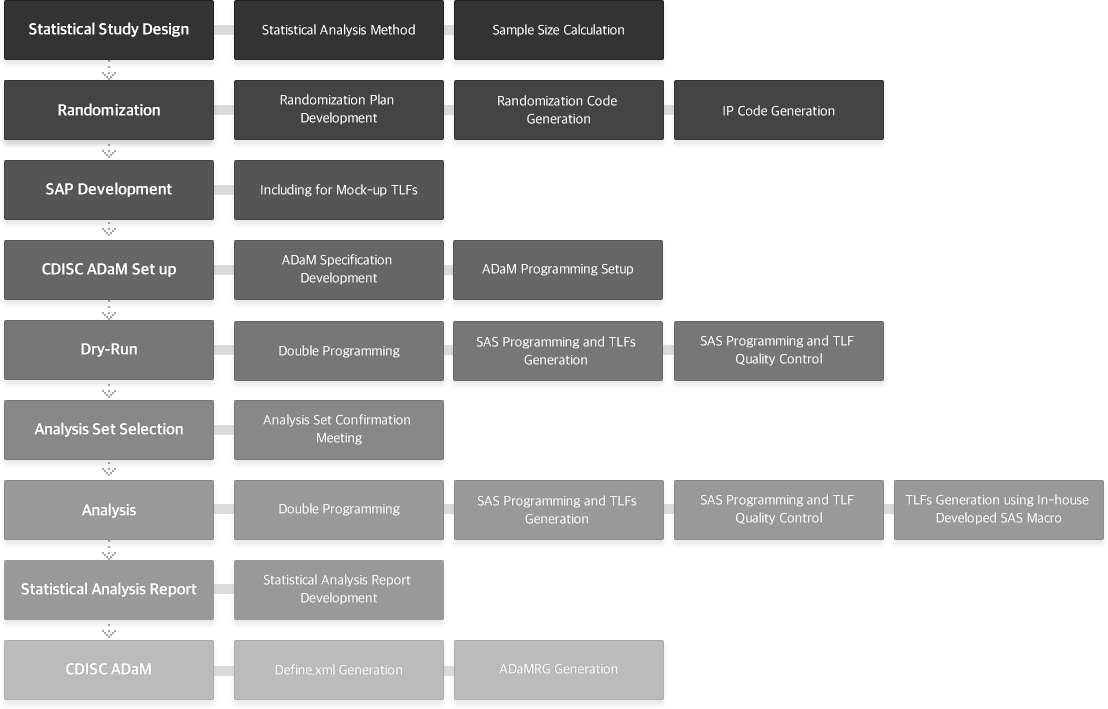
HYUNDAI ADM BIO 통계팀은 풍부한 실무경험과 효율적인 프로세스를 바탕으로 연구 디자인, 샘플사이즈, 무작위배정, 분석 계획 수립 및 분석 결과 도출, 분석 보고서 작성, CDISC 표준에 따른 결과 생성까지 임상시험, 시판 후 조사, 의료기기 등 다양한 임상연구 및 치료영역에서 전문적이고 신뢰성 있는 서비스를 제공하고 있습니다.
서비스 범위(Service Scope)
- Statistical Study Design and
Sample Size Calculation - Statistical Analysis Strategies
- Randomization
- Statistical Analysis Plan
- Dry-Run Process
- Statistical Analysis Programing
- Tables, Figures and Listings
- Statistical Analysis Report
- CDISC ADaM (Analysis Data Model)
- RWD/RWE Studies
서비스 프로세스 (Service process)
- Statistical Study Design and
-

서비스 개요(About Service)
HYUNDAI ADM BIO는 제품 개발이 효율적이고 효과적으로 실행될 수 있도록 우수한 품질의 규제 서비스를 제공하고 있습니다. 의약품/의료기기 제품의 초기 개발부터 허가까지의 경험이 풍부하고 관련 규정에 이해도가 높은 전문 인력이 올바른 규제 전략을 제시하여 고객님이 효율적으로 허가 받을 수 있도록 도움을 드리고 있습니다.
서비스 범위(Service Scope)
- Strategic and Regulatory Drug
Development Consulting - Preparation and Document
Validation of Registration Dossier - IND & NDA Application Support
-
Scientific and Medical
Communication with
Regulatory Authorities - Post-Approval Maintenance Support
서비스 프로세스 (Service process)
- Regulatory Strategy for
Drug development - Package Preparation
- Submission
- Regulatory
authority review - Follow up during regulatory
authority review process - Approval & Post-Approval
management
- Strategic and Regulatory Drug